Тканевая инженерия
Тканевая инженерия (ТИ), как дисциплина, начала свою историю в первой половине XX века. Фундаментом для её основания послужили теоретические и практические разработки по созданию "искусственных" органов и тканей и работы по трансплантации клеток и биологически активных компонентов на носителях для восстановления повреждений в различных тканях организма (Langer R., Vacanti J.P., 1993).
В настоящее время, тканевая инженерия является одной из наиболее молодых отраслей в медицине, базирующейся на принципах молекулярной биологии и генной инженерии. Используемый в ней междисциплинарный подход направлен в первую очередь на создание новых биокомпозиционных материалов для восстановления утраченных функций отдельных тканей или органов в целом (Spector M., 1999). Основные принципы данного подхода заключаются в разработке и применении при имплантации в поврежденный орган или ткань носителей из биодеградирующих материалов, которые используются в сочетании либо с донорскими клетками и/или с биоактивными веществами. Например, при лечении раневого процесса - это могут быть коллагеновые покрытия с аллофибробластами, а в сосудистой хирургии - искусственные сосуды с антикоагулянтами (Vacanti С.А. et.al., 1993). Кроме того, одним из серьезных требований к такого рода материалам-носителям является и то, что они должны обеспечивать надежную поддерживающую, то есть опорную и/или структурообразовательную функцию в поврежденной области ткани или органа.
Следовательно, одной из основных задач тканевой инженерии в области лечения костных патологий является создание искусственных биокомпозитов, состоящих из алло- и/или ксеноматериалов в сочетании с биоактивными молекулами (костные морфогенетические белки, факторы роста и т.д.) и способных индуцировать остеогенез. При этом такие биоматериалы должны обладать рядом необходимых свойств кости (Yannas I.V. et.al., 1984; Reddi A.H.et.al., 1987; Reddi A.H., 1998).
- Во-первых, они должны выполнять и поддерживать (scaffold) объем дефекта.
- Во-вторых, обладать остеоидуктивностью, то есть активно побуждать остеобласты и, возможно, другие мезенхимальные клетки к формированию кости.
- И, в-третьих, иметь хорошие показатели биоинтеграции и биосовместимости, то есть быть деградируемыми и не вызывать у рецепиента воспалительных и иммунных реакций. Последнее качество обычно достигается в биоматериале только за счет снижения его антигенных характеристик.
Совокупность всех этих свойств позволяет таким биоматериалам параллельно с опорной, механической функцией, обеспечивать и биоинтеграцию - врастание клеток и сосудов в структуры имплантата с последующим формированием костной ткани.
Известно, что поддерживающий эффект любого биоматериала обеспечивается, как правило, его структурными особенностями. Для биоматериалов этот показатель обычно связан с архитектоникой нативной ткани, из которой он получен. Для кости, основными параметрами её структурной прочности являются твердо-эластические характеристики костного матрикса и величина пор в нем (Marra P. G.1998; Thomson R.C. et.al., 1998).
К наиболее распространенным биоматериалам с четко выраженной опорной функцией относятся искусственный и натуральный гидроксиапатит (ГА), биокерамика, полигликолевая кислота, а также коллагеновые белки (Friess W.,1998).
В настоящее время для замещения костных дефектов в хирургической стоматологии, ортопедии и травматологии используются много различных форм гидроксиапатита, отличающихся по форме и величине частиц. Считается, что искусственно полученный гидроксиапатит, по химическому составу и кристаллографическим показателям практически идентичен гидроксиапатиту нативной кости (Parsons J., 1988). Многими авторами и экспериментально, и клинически показано, что использование гидроксиапатита имеет значительные преимущества перед другими имплантационными материалами. Так, к его положительным характеристикам относятся такие показатели как легкость стерилизации, продолжительный срок хранения, высокий уровень биосовместимости и крайне медленная резорбция в организме (Воложин А.И. и соавт., 1993). Гидроксиапатит является биоинертным и хорошо совместимым с костью материалом (Jarcho M. et.al., 1977), как было показано с помощью экспериментальных исследований. В процессе замещения костного дефекта в присутствии ГА под влиянием биологических жидкостей и тканевых ферментов гидроксиапатит может частично или полностью резорбироваться (Klein А.А.,1983). Положительный эффект гидроксиапатита после его имплантации в костную полость объясняется, по-видимому, не только остеокондуктивными свойствами материала, но и его способностью сорбировать на своей поверхности белки, индуцирующие остеогенез (Ripamonti U., Reddi A.H., 1992).
В настоящее время основную часть биоматериалов для восстановления костных дефектов получают из хрящевой и/или костной тканей человека или различных животных. Часто для изготовления композиционных материалов используются компоненты и других видов соединительной ткани - кожи, сухожилий, мозговой оболочки и т.д. (Воупе P.J., 1979; Yannas I.V. et.al., 1982; Chvapel M., 1982; Goldberg V.M. et.al., 1991; Damien C.J., Parsons J.R., 1991).
Наиболее известным из современных биоматериалов является коллаген. Его широкое применение в практической медицине связано с развитием реконструктивной хирургии и поиском новых материалов, выполняющих каркасную и пластическую функции при регенерации тканей. К основным достоинствам коллагена - как пластического биоматериала следует отнести его низкую токсичность и антигенность, высокую механическую прочность и устойчивость к тканевым протезам (Истранов Л. П., 1976). Источниками получения коллагена при изготовлении изделий для пластической хирургии служат ткани богатые этим белком - кожа, сухожилия, перикард и кость. Широкое распространение в медицинской практике получил раствор кожного коллагена, выпускаемый фирмой Collagen Corp. (Palo-Alto USA), под названиями "Zyderm" и "Zyplast". На основе этого коллагена были разработаны различные изделия медицинского назначения такие как - имплантаты, покрытия для ран, хирургические нити для ушивания раневых поверхностей и т.д.
В 70-х годах прошлого столетия были впервые получены данные о влиянии коллагеновых трансплантатов на репарацию костной ткани. При этом было установлено, что коллагеновые имплантаты способствуют пролиферации фибробластов, васкуляризации близлежащих тканей и, по-видимому, индуцируют формирование новой костной ткани с последующей ее перестройкой (Reddi A.H., 1985). В качестве быстро биодеградирующего материала коллаген был применен и в виде геля при восстановлении костных дефектов (De Balso A.M., 1976). Полученные данным автором результаты также позволили предположить, что препараты на основе коллагена способны стимулировать регенерацию костной ткани.
В это же время для замещения дефектов костной ткани были начаты исследования и по применению биокомпозиционных материалов, содержащих одновременно и коллаген, и гидроксиапатит. Так, для челюстно-лицевой хирургии и хирургической стоматологии были разработаны композиции "Alveloform" и "Bigraft", содержащие очищенный фибриллярный кожный коллаген и частицы ГА (фирма Collagen Corp., Palo Alto, USA). Данные биоматериалы были применены для восстановления альвеолярного гребня при хирургическом лечении больных с парадонтитами (Krekel G. 1981, Lemons M.M.1984, Miller E. 1992 ). Гистологические и ультраструктурные исследования доказали, что композиция - коллаген и ГА положительно влияет на регенерацию кости гребня, но при этом такого рода биоматериалы выполняют главным образом каркасную и проводниковую функции, то есть проявляют свои остеокондуктивные свойства (Mehlisch D.R., 1989). Позднее к аналогичным выводам пришли и многие другие исследователи и в настоящее время этой точки зрения придерживается большинство ученых (Glimcher M.J., 1987; Friess W., 1992; VaccantiC.A. et.al., 1993).
Тем не менее, по данным другой группы исследователей биокомпозиционные материалы, содержащие кожный коллаген "Ziderm" и синтетический гидроксиапатит, обладают определенными остегенными потенциями. Так, Katthagen и соавт. (1984), изучая действие материала "Коллапат", содержащего кожный коллаген типа 1 и частицы высоко дисперсного гидроксиапатита, на восстановление костных дефектов бедренной кости у кроликов, установили, что регенерация костной ткани у опытных животных протекала в 5 раз быстрее, чем в контроле. Эти экспериментальные результаты легли в основу дальнейшего применения материала "Коллапат" в клинической практике.
Общеизвестно, что наиболее подходящими для трансплантации и последующей биоинтеграции несомненно являются аутотрансплантаты, которые готовятся из собственных тканей пациента и этим полностью исключаются основные иммунологические и большинство инфекционных осложнений при последующей пересадке (Enneking W.F. et.al., 1980; Summers B.N., Eisenstein S.M.,1989; Reddi A.H., 1985; Goldberg V.M. et.al., 1991). Однако, такие материалы должны готовиться непосредственно перед трансплантацией, в противном случае клиника должна иметь костный банк для хранения такого биоматериала, что в реальности доступно только очень крупным медицинским учреждениям из-за высокой стоимости приготовления и хранения данных материалов. Кроме того, возможности получения значительных количеств аутоматериала весьма ограничены и при его заборе, как правило, донор подвергается серьезным оперативным вмешательствам. Все это существенно ограничивает широкое применение аутотрансплантатов (Bos G.D. et.al., 1983; Horowitz M.C. 1991). Следовательно, в области лечения костных патологий перед тканевой инженерией стоит реальная задача по созданию биокомпозиционных материалов, применение которых обеспечит решение многих проблем как по трансплантации клеток и стимуляции формирования кости в местах ее повреждения, так и по снижению трудовых и финансовых затрат при устранении костных повреждений у больных различного профиля.
В настоящее время усилиями ряда исследователей, работающих в области тканевой инженерии, были разработаны и внедрены биокомпозиционые материалы, в состав которых входят как нативные клетки костного мозга, так и стромальные остеогенные клетки-предшественнники, выращенные в монослойных культурах костного мозга (Gupta D., 1982; Bolder S., 1998). Этими авторами было установлено, что для успешной индукции остеогенеза в месте трансплантации необходимо создать высокую, начальную плотность стромальных предшественников - порядка 108 клеток. При этом простое введение суспензии таких клеток не давало хороших результатов. В связи с этим возникла серьезная проблема поиска носителей для трансплантации клеток в организм реципиента.
Впервые в качестве такого носителя Gupta D. et. al. (1982) предложили использовать ксенокость, предварительно обезжиренную и декальцинированную. Далее было установлено, что в зависимости от степени очистки ксенокости процент прикрепления клеточных элементов к носителю увеличивается, и клетки значительно лучше связываются с органической его частью, чем с природным костным гидроксиапатитом (Hofman S., 1999).
Из синтетических материалов в качестве носителей для трансплантации клеток в настоящее время широко применяют керамику (Burder S. 1998), которая представляет из себя искусственный гидроксиапатит, полученный при обработке три-кальций фосфата высокими температурами.
Отечественные стоматологи-хирурги в качестве подходящего носителя для трансплантации аллогенных фибробластов использовали твердую мозговую оболочку и отметили, что применение данного трансплантата с аллофибробластами при лечении хронического генерализованного пародонтита средней и тяжелой степени имеет ряд преимуществ перед другими способами лечения (Дмитриева Л.А., 2001).
Ранее в серии работ по конструированию "искусственной кожи" было обнаружено, что успех восстановления данной ткани после её повреждения зависит от состояния клеточного микроокружения в поврежденном участке. С другой стороны, само микроокружение создается оптимальным сочетанием основных компонентов межклеточного матрикса, таких как коллагены, гликопротеины и протеогликаны (Yannas I. et.al., 1980, 1984; Pruitt В., Levine N., 1984; Madden M. et.al., 1994).
Коллаген является типичным фибриллярным белком. Его индивидуальная молекула - тропоколлаген состоит из трех спирализованных полипептидных цепей, называемых a-цепями, которые скручены между собой в одну общую спираль и стабилизированны водородными связями. Каждая a-цепь содержит в среднем около 1000 аминокислотных остатков. В костной ткани существует две основных комбинации цепей - две λ1 и одна λ2 или коллаген типа 1 и три λ-1 или коллаген типа III. Кроме названных типов в кости были обнаружены в минорных количествах и другие изоформы коллагена (Серов В. П., Шехтер А. Б., 1981).
Протеогликаны это сложные соединения полисахаридов с белком. Полисахариды, входящие в состав протеогликанов, представляют из себя линейные полимеры, построенные из разных дисахаридных субъединиц, образованных уроновыми кислотами (глюкуроновой, галактуроновой и идуроновой), N-ацетилгексозаминами (IM-ацетилглюкозамин, N-ацетил-галактозамин) и нейтральными сахаридами (галактозой, маннозой и ксилозой). Эти полисахаридные цепи называются гликозаминогликанами. По меньшей мере один из Сахаров в дисахариде имеет отрицательно заряженную карбоксильную или сульфатную группу (Стейси М., Баркер С,1965). Зрелая костная ткань содержит в основном сульфатированные гликозаминогликаны (сГАГ), такие как хондроитин-4- и хондроитин-6-сульфаты, дерматан-сульфат и кератан-сульфат. Биосинтез протеогликанов в костной ткани осуществляется главным образом активироваными остеобластами и в незначительной степени зрелыми остеоцитами (Juliano R., Haskell S., 1993; Wendel M., Sommarin Y., 1998).
Функциональное значение сульфатированных гликозаминогликанов в соединительной ткани (СТ) велико и связано в первую очередь с формированием коллагеновых и эластиновых волокон. Сульфатированные гликозаминогликаны участвуют практически во всех процессах обмена соединительной ткани и могут оказывать модулирующее влияние на дифференцировку её клеточных элементов (Панасюк А.Ф. и соавт., 2000). От их качественных и количественных характеристик в тканях, а также специфики взаимодействия с другими компонентами межклеточного матрикса, зависят многие показатели регенерации СТ.
Регенерация и восстановление костной ткани представляют из себя комплекс последовательных процессов, включающих как активацию клеток остеогенного ряда (рекрутирование, пролиферацию и дифференцировку), так и непосредственное формирование специализированного матрикса - его минерализацию и последующее ремоделирование костной ткани. При этом данные клетки всегда находятся под контролем и влиянием ряда биологических и механических факторов [YangX., Oreffo R.O.C., 2005].
По современным представлениям [Goldstein S.A.et.al., 1999, Панасюк А.Ф. и соавт, 2004] тканевая инженерия (ТИ) костной ткани опирается на три основных принципа, обеспечивающих успешное замещение данной ткани.
Во-первых, наиболее важным принципом при создании биоматериалов и конструкций для имплантации является воспроизведение основных характеристик природного костного матрикса, потому что именно уникальное cтроение костной ткани оказывает самое выраженное влияние на процессы регенерации. Известно, что эти характеристики матрикса зависят от его трехмерной структуры и химического состава, а также от его механических свойств и способности влиять на клеточные формы соединительной ткани (СТ).
Архитектоника матрикса включает в себя такие параметры как соотношение поверхности к объему, наличие системы пор, и, что наиболее важно, его функциональные и механические свойства. Благодаря этим показателям матрикс, по-видимому, может регулировать врастание сосудов, обеспечивать хемотактические стимулы для эндогенных клеток, модулировать клеточное прикрепление, стимулировать деление, дифференцировку и последующую минерализацию. Считается, что трехмерная структура построения матрикса может влиять не только на процессы индукции, но и на саму скорость регенерации [Sachlos E., Czernuszka J.T., 2003].
Следовательно, конструируемый с помощью тканевой инженерии биоматериал или конструкция должны обладать свойствами, которые в условиях in vivo способны обеспечивать как кондуктивные, так и индуктивные свойства природного матрикса. К первым относятся такие показатели как способность заполнения и поддержания объема, механическая интеграция, обеспечение проницаемости для клеток и сосудов. Вторые - обеспечивают прямое или опосредованное воздействие на клеточные формы, стимулируя их к формированию хрящевой и/или костной тканям.
Следующим важным принципом успеха направленной костной тканевой инженерии является применение экзогенных и/или активация эндогенных клеток, которые непосредственно участвуют в процессах созидания данной ткани. При этом источником таких клеток может быть как собственный, так и донорский организм. Например, использование определенных клеточных типов от плюрепотентных стромальных клеток костного мозга до коммитированных остеобластоподобных клеток были успешно использованы и в экспериментах на животных, и в клинике [Hofmann A.et.al., 2005].
Как правило, при обратной трансплантации в организм стромальные клетки-предшественники способны дифференцироваться в зрелые формы, синтезировать матрикс и запускать каскад эндогенных реакций репарации костной ткани. Вместе с тем, альтернативный взгляд на применение композиционных биоматериалов предполагает их непосредственное воздействие на эндогенные костные и другие клетки соединительной ткани, их рекрутирование (привлечение) в зону имплантации, стимуляцию их пролиферации и повышение их биосинтетической активности, принуждая эти клетки активно формировать костную ткань. Кроме того, такие материалы могут быть хорошими клеточными носителями, на которых возможно выращивание стволовых клеток перед их трансплантацией. Последним из главных принципов успеха тканевой инженерии кости является применение биоактивных молекул, включающих факторы роста, цитокины, гормоны и другие биологически активные вещества.
Для индукции костеообразования наиболее известными факторами являются костные морфогенетические белки, трансформирующий фактор роста - TGF-β , инсулиноподобный фактор роста IGF и фактор роста эндотелия сосудов VEGF.[Lakes S.R., 2003]. Следовательно, биокомпозиционный материал может быть насыщен и/или содержать в своей структуре данные биоактивные молекулы, что позволяет использовать его при имплантации в качестве депо для таких субстанций. Постепенное высвобождение данных факторов может активно влиять на процессы костного восстановления. Кроме данных веществ в состав композиционных материалов могут входить микро- и макроэлементы, а также другие молекулы (сахара, пептиды, липиды и т.д.), способные обеспечивать стимуляцию и поддержание повышенной физиологической активности клеток в восстанавливающейся костной ткани.
В настоящее время существует большое количество разнообразных биопластических материалов, которые обладают остеокондуктивными и/или остеоиндуктивными свойствами [Griffith L.G., 2000]. Так, материалы, содержащие практически чистый гидроксиапатит (ГА), такие как "Остеогаф", "Био-Осс", "Остеомин", "Остим" проявляют главным образом кондуктивные свойства, хотя они и способны оказывать слабый остеоиндуктивный эффект. Другая группа материалов представляет из себя полностью или частично деминерализованную костную ткань, а так же сочетаниями этих материалов с биологически активными субстанциями, такими как костные морфогенетические белки и/или факторами роста [Панасюк А.Ф. и соавт, 2004].
Наиболее важными требованиями к биопластическим материалам остаются такие параметры, как их антигенные и индуктивные свойства. Кроме того, для разного рода операций часто требуются материалы, обладающие, наряду с вышеуказанными показателями, хорошими пластическими или прочностными характеристиками для создания и поддержания необходимых форм и конфигураций при заполнении полостей и тканевых дефектов.
С учетом всего сказанного выше, фирмой ООО "Конектбиофарм" была разработана технология получения костного коллагена и костных сульфатированных гликозаминогликанов (сГАГ) и на их основе изготовлены биокомпозиционные остеопластические материалы серий "Биоматрикс" и "Остеоматрикс". Основное различие между этими группами биоматериалов состоит в том, что "Биоматрикс" содержит костный коллаген и костные сульфатированные гликозаминогликаны, а "Остеоматрикс", имея в своем составе те же два основных компонента костной ткани, содержит ещё и гидроксиапатит в природной форме [Панасюк А.Ф. и соавт, 2004]. Источником этих биоматериалов являются губчатые и кортикальные кости различных животных, а также человека. Полученный по данной технологии костный коллаген не содержит других белков и, в условиях in vitro, практически не растворим в достаточно концентрированных растворах щелочей и органических кислот.
Это свойство позволяет биоматериалам быть не только инертными в отношении иммунной системы организма, но и в течение длительного времени после их имплантации быть устойчивым к биораспаду. В настоящее время для ускорения роста кости и мягких тканей активно применяется методика стимуляции клеток богатой тромбоцитами плазмой (БоТП). Эта новая биотехнология направленной тканевой инженерии и клеточной терапии является по мнению ряда авторов настоящим прорывом в хирургической практике [Marx R.E., 2003]. Однако, для получения такой плазмы требуется определенное техническое оснащение, а в ряде случаев и специально подготовленные сотрудники [Tamimi F.M. et.al., 2007]. Использование для этих целей материала "Биоматрикс" полностью решает настоящую проблему с минимальными затратами потому, что нет необходимости выделять тромбоциты из крови пациента. В серии экспериментов нами было установлено, что материал "Биоматрикс" способен специфически и в больших количествах связывать тромбоциты периферической крови (табл.1).
Таблица 1. Связывание тромбоцитов крови костным коллагеном.
| Концентрация тромбоцитов в мл крови ( х 106)* | ||||
| Время инкубации (мин) | 0 | 5 | 10 | 15 |
| Донор 1 | 240.0 | 74.4 | 14.6 | 13.4 |
| Донор 2 | 286.0 | 71.5 | 37.2 | 26.2 |
| Донор 3 | 324.0 | 84.2 | 22.7 | 19.4 |
* - 6 мл крови инкубировали с 1 гр костного коллагена (1 гр. сухого костного коллагена занимает объем от 2 до 7 см³ в зависимости от величины его пористости). Данные в таблице представлены как содержание тромбоцитов в 1 мл крови после её пропускания через 1 см³ костного коллагена.
Так, 1 см³ биоматериала "Биоматрикс" способен связывать практически все тромбоциты (более 90%) из 1 мл крови, то есть от 226 до 304 миллионов тромбоцитов. При этом связывание тромбоцитов костным коллагеном происходит быстро и завершается в течение нескольких минут (график 1).
График 1. Скорость связывания тромбоцитов крови костным коллагеном.
Было установлено также, что, если биоматериал "Биоматрикс" применялся без прикрытия антикоагулянтами, то формирование сгустка происходило практически мгновенно. В настоящее время доказано, что рабочая концентрация для богатой тромбоцитами плазмы начинается с 1 миллиона тромбоцитов в мкл.[Marx R.E., 2003].Следовательно, для получения богатой тромбоцитами плазмой тромбоциты крови необходимо сконцентрировать в среднем в 5 раз, но при этом такое выделение требует и существенных финансовых затрат, и определенного профессионального опыта. Кроме того, для активации тромбоцитов и выделения ими 7 факторов роста: 3-х видов PDGF-aa, -bb, -ab, двух трансформирующих факторов роста - TGF-β1 и β2 , фактора роста эндотелия сосудов VEGF и фактора роста эпителия EGF - богатая тромбоцитами плазма перед её употреблением должна быть коагулирована [Ogino Y. et.al.,2006 ]. По сравнению с известными методами, на биоматериале "Биоматрикс" удается существенно повысить концентрирование тромбоцитов. Одновременно с этим коллаген является именно тем белком, который способен активировать фактор Хагемана (ХII фактор свертывания крови) и систему комплемента.
Известно, что активированный фактор Хагемана запускает каскад реакций системы свертывания крови и приводит к образованию сгустка фибрина. Данный фактор или его фрагменты способны инициировать также калликреин-кининовую систему крови. Таким образом, костный коллаген в составе материалов "Биоматрикс" и "Остеоматрикс" способен активировать основные системы протеолиза плазмы крови, которые ответственны за поддержание гемодинамического равновесия и обеспечение регенераторных реакций организма. В отличие от богатой тромбоцитами плазмой, которая сама не обладает остеоиндуктивным эффектом, то есть не может инициировать образование кости без присутствия костных клеток, материалы "Биоматрикс" и "Остеоматрикс" обладают такой потенцией.
Так, при внутримышечной имплантации биоматериалов "Биоматрикс" и, особенно, "Остеоматрикс" происходит формирование эктопическое костной ткани, что непосредственно доказывает остеоиндуктивную активность данных материалов [Иванов С.Ю. и соавт., 2000]. Совместное применение богатой тромбоцитами плазмы с рекомбинантным костным морфогенетическим белком, который может стимулировать клетки соединительной ткани к формированию костной ткани, решает данную проблему, но это приводит к существенному удорожанию методики. Необходимо отметить также, что материалы серии "Остеоматрикс" имеют в своем составе природный костный гидроксиапатит, который способен аффинно аккумулировать на своей поверхности синтезируемые остеобластами костные морфогенетические белки, и таким образом дополнительно стимулировать остеогенез ("наведенная остеоиндукция").
При этом полностью снимается возражение о возможности развития опухолей [Marx R.E., 2003] вследствии использования рекомбинантных белков потому, что в случае аналогичного применения материалов "Биоматрикс" и "Остеоматрикс" в зоне имплантации присутствуют только естественные белки природного происхождения. Материалы серий "Биоматрикс" и "Остеоматрикс" обладают и другим уникальным качеством – они способны аффинно связывать сульфатированные гликозаминогликаны [Панасюк А.Ф., Саващук Д.А., 2007]. Это связывание в условиях подобно связыванию тромбоцитов происходит за короткий промежуток времени и количество связавшихся сульфатированных гликозаминогликанов значительно превышает физиологические показатели (таблица 2).
Таблица 2. Связывание сульфатированных гликозаминогликанов костным коллагеном.
| Связывание - мг сГАГ / гр сухого коллагена* | |||||
| Время инкубации (мин) | 5 | 10 | 20 | 60 | 120 |
| Опыт 1 | 31 | 51 | 73 | 91 | 93 |
| Опыт 2 | 29 | 58 | 69 | 95 | 92 |
| Опыт 3 | 32 | 64 | 74 | 92 | 93 |
В настоящее время хорошо известно, что применяемые по отдельности и коллаген, и гидроксиапатит обладают в основном остеокондуктивными свойствами, то есть способны играть роль только «способствующего» материала для создания новой кости. Однако, эти молекулы могут оказывать на клетки остеобластического ряда и слабый остеоиндуктивный эффект, за счет некоторых своих биологических свойств.
Этот остеоиндуктивный эффект усиливается при комплексном применении этих двух типов молекул [Damien C.J., Parsons J.R., 1991]. С другой стороны, если вместе с коллагеном и гидроксиапатитом в биоматериалах будут представлены и сульфатированные гликозаминогликаны, то такой комплекс по своей структуре будет более близок к природному костному матриксу и, следовательно, обладать его функциональными характеристиками в более полном объеме. Так, известно, что сульфатированные гликозаминогликаны оказывают влияние на многие показатели обмена соединительной ткани.
Они способны снижать активность протеолитических ферментов, подавлять синергическое действие на межклеточный матрикс данных ферментов и кислородных радикалов, блокировать синтез медиаторов воспаления за счет маскировки антигенных детерминант и отмены хемотаксиса, предотвращать апоптоз клеток, индуцированный повреждающими факторами, а также снижать синтез липидов и с помощью этого препятствовать процессам деградации. Кроме того, эти соединения принимают непосредственное участие в построении самих коллагеновых волокон и межклеточного матрикса в целом.
На ранних этапах повреждения соединительной ткани они выступают как инициаторы создания временного матрикса и позволяют преостановить распад соединительной ткани и формирование грубого рубца, а в последствии обеспечить и более быстрое его замещение на обычную для данного органа соединительную ткань [Панасюк А.Ф. и соавт, 2000]. К сожалению, роль сульфатированных гликозаминогликанов в регуляции остеогенеза изучена недостаточно, однако, показано, что основным претендентом на роль индуктора эктопического остеогенеза в модельной системе является протеогликан, секретируемый клетками эпителием мочего пузыря [Фриденштейн А.Я., Лалыкина К.С., 1972].
Аналогичного мнения придерживаются и другие авторы [6], считая, что протеогликаны являются одним из факторов стромального микроокружения, регулирующим гемопоэз и другие гистогенезы производных мезенхимы. Кроме того, показано, что в условиях in vitro и in vivo хондроитин-сульфаты оказывают выраженное влияние на минерализацию кости [Burger M.] Так, нами было выявлено, что при воздействии материала "Остеоматрикс" на культуру хондроцитов человека происходит индукция их хондрогенных свойств. Под влиянием материала хондроциты человека формировали в культуре гистотипические структуры, в которых зго за отложение фосфатов и минерализацию костного матрикса в процессе его оссификации.
Далее, было установлено, что после имплантации кроликам биоматериалов "Биоматрикс", "Алломатрикс-имплант" и "Остеоматрикс" происходит формирование эктопической кости с последующим заселением её костным мозгом. Кроме того, данные материалы были успешно применены и в качестве носителей при трансплантации стволовых стромальных клеток-предшественников [Иванов С.Ю. и соавт., 2000]. К настоящему времени эти материалы завоевали признание как в стоматологической, так и в ортопедической практике [Иванов С.Ю. и соавт., 2000, Лекишвили М.В. и соавт., 2002, , Грудянов А.И. и соавт., 2003, Аснина С.А. и соавт., 2004, Васильев М. Г. и соавт., 2006]. С высокой эффективностью они были применены в случаях несовершенного остеогенеза, восстановлении кисти, при хирургическом лечении заболеваний пародонта и устранении дефектов челюстных костей. Эти биоматериалы, благодаря разработанной технологии их изготовления, являются пока единственными во всем мире материалами, у которых практически полностью сохранена коллагеновая и минеральная структуры природной кости, но при этом данные материалы полностью лишены антигенности.
Большим достоинством этих биоматериалов является и то, что они содержат костные сульфатированные гликозаминогликаны, аффинно связанные с коллагеном и гидроксиапатитом, что существенно отличает их от имеющихся в мире аналогов и значительно усиливает их остеогенные потенции. Таким образом, приведенные экспериментальные и клинические данные реально доказывают, что базируясь на современных принципах тканевой инженерии были разработаны и внедрены в клиническую практику отечественные биокомпозиционные материалы на основе костных коллагена, сульфатированных гликозаминогликанов и гидроксиапатита. Эти современные, эффективные и безопасные биоматериалы нового поколения открывают широкие перспективы к решению многих проблем восстановления костной ткани в травматологии и ортопедии, а также во многих других областях хирургической практики.
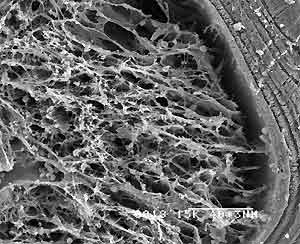
На электоннограмме (рис.1) видно, что препараты костного коллагена представляют из себя сеть упорядоченно расположенных пучков и волокон. При этом сами волокна плотно упакованы в пучки второго порядка, без разрывов и дефектов. По своему виду материал имеет классическую пористо-ячеистую структуру, которая полностью соответствует архитектонике нативной губчатой кости и свободна от сосудов, белков, механических и иных включений. Размер пор колеблется от 220 до 700 мкм.
Биосовместимость костного коллагена была оценена нами по стандартным тестам в условиях имплантации их под кожу крысам породы Вистар. С помощью гисто-морфологического анализа и сканирущей электронной микроскопии было установлено, что костный коллаген после полуторамесячного пребывания в организме рецепиента практически не подвергается разрушению и сохраняет свою структуру.
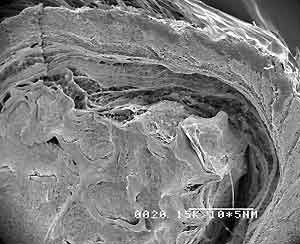
Как видно на рис.2, поры, трабекулы и ячейки имплантированного костного коллагена частично заполняются рыхлой волокнистой СТ, волокна которой слабо спаяны с имплантатом. Хорошо видно, что вокруг него формируется незначительный фиброзный слой, а в самом имплантате отмечается присутствие небольшого количества клеточных элементов, основными из которых являются фибробласты. Характерно, что имплантат практически на всем своем протяжении не спаян с окружающей тканью дермы. Эти результаты однозначно свидетельствуют о высокой устойчивости данного материала к биораспаду и о полной биоинертности в отношении него окружающей соединительной ткани.
Исследования по влиянию биоматериалов "Биоматрикс", "Алломатрикс-имплант" и "Остеоматрикс" на остеорепарацию мы провели на модели сегментарной остеотомии по общепринятым методикам (Katthagen B.D., Mittelmeeir H., 1984; Schwarz N. et.al.,1991). В эксперименте были использованы кролики породы Шиншилла массой 1,5-2,0 кг, которым под внутривенным наркозом делали сегментарную остеотомию лучевой кости.
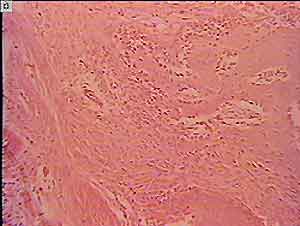
Через два месяца после операции в зоне имплантации было отмечено формирование новой костной ткани. На рис. 3 результат гистоморфологического исследования материала "Алломатрикс-имплант" через 2 мес. после операции. В проксимальной зоне дефекта видна хорошо развитая молодая костная ткань. Остеобласты прилежат к костным балкам в большом числе.
В межуточном веществе обнаруживаются остециты в лакунах, В новом костном веществе формируются плотно упакованные коллагеновые волокна. Хорошо развито межуточное вещество с активными клетками. Зона имплантата (сверху и слева) активно перестраивается.
В общем, идет ускоренное созревание костной ткани вокруг зоны имплантата.
Кроме того, оказалось, что пористо-ячеистая структура костного коллагена обеспечивает не только поддержание объема в дефекте за счет своих упруго-эластических качеств, но и оптимальную возможность для врастания в него клеток соединительной ткани, развития сосудов и формирования кости при замещении этого дефекта.

Так например, через 2 месяца после имплантации биоматериала "Алломатрикс-имплант" большинство пор имплантата заполнены безклеточным тонковолокнистым материалом, в ряде пор выявляли, сформированные сосуды ( внизу слева). Стенка сосуда плотная, внутри сосуда видны форменные элементы крови – эритроциты. Коллагеновые волокна имплантата уплотнены, без явлений деструкции (рис. 4).
Очень важным свойством имплантируемого остеопластического материала является его способность индуцировать развитие сосудов потому, что именно оно потенциально определяет его остеоиндуктивные потенции. Биопластический материал "Биоматрикс" представляет из себя высокоочищенный коллаген губчатой кости быка или свиньи и содержит суммарную фракцию костных сульфатированных гликозаминогликанов.
Он имеет естественную пористость, присущую нативной кости, и изготовляется в виде блоков пластин и дисков. "Биоматрикс" нетоксичен, обладает хорошей биосовместимостью и с его помощью можно моделировать любую форму костного дефекта, что было доказано нами в экспериментах на животных. Наряду с хорошими остекондуктивными характеристиками "Биоматрикс" обладает и выраженными остеоиндуктивными свойствами. В условиях in vitro блоки материала "Биоматрикс" имеют высокую степень устойчивости к растворам кислот и щелочей, а в условиях in vivo - и к биораспаду.

